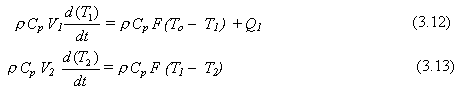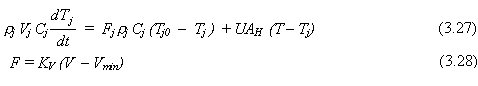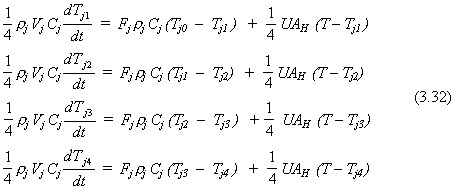3.1 INTRODUCCIÓN
Al leer los capítulos anteriores, se puede reconocer que las ecuaciones desarrolladas en los ejemplos constituyen partes de modelos matemáticos. Este capítulo está dirigido a mostrar ejemplos más completos. Iniciaremos con los sistemas más simples y progresivamente se verán procesos mas realistas y complejos. El ejemplo más complejo corresponde a una columna de destilación de múltiple componentes con flujos no ideales, no equimolares, en la cual se necesitan un número grande de ecuaciones para una rigurosa descripción del sistema.
Puede ser imposible incluir en este texto modelos matemáticos para todos los tipos de sistemas de ingeniería química. Los ejemplos cubren un número de muchas piezas de equipos comúnmente encontradas: tanques, reactores de diferentes tipos, y columnas de destilación (continuas y “batch”). Se espera que estos ejemplos específicos (o casos de estudio) de modelamiento matemático den a Ud. las estrategias y procedimientos para que pueda aplicarlos en problemas específicos. Recordar, solo ir a lo básico cuando se procede en una situación nueva. Usar los balances dinámicos de masa y energía aplicados a su sistema.
3.2 REACTORES CSTR EN SERIE, CON RETENCIÓN CONSTANTE
El sistema es mostrado en la Fig. 3-1 y es una simple extensión del CSTR considerado en el Ejemplo 2.3. El producto B es formado y el reactante A es consumido en cada uno de los tres reactores perfectamente mezclados mediante una reacción de primer orden llevándose a cabo en el liquido. Por el momento asumimos que las temperaturas y retenciones (volúmenes) de los tres tanques pueden ser diferentes, pero tanto las temperaturas y el volumen de liquido en cada tanque se asumen a ser constantes (isotérmico y a volumen constante). Se asume densidad constante a lo largo del sistema, el cual es una mezcla binaria de A y B.
Con estas asunciones en mente, podemos formular nuestro modelo. Si el volumen y densidad de cada tanque son constantes, la masa total en cada tanque es constante. Luego la ecuación de continuidad total para el primer reactor es:
o F0 = F1
Asimismo, un balance total de masa en los tanques 2 y 3 da
F3 = F2 = F1 = F0 = F (3.2)
Donde F se define como el flujo (m3/min)
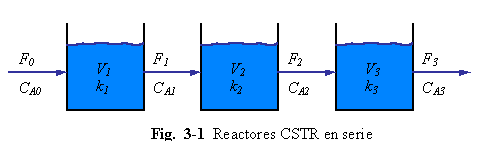 |
Si se quiere determinar las cantidades de reactante A y producto B en cada tanque, son necesarias las ecuaciones de continuidad por componente. Sin embargo, como el sistema es binario y se conoce la cantidad total de masa de material en cada tanque, solamente es necesaria una ecuación de continuidad de componente. Se pueden usar ya sea A o B. Si elegimos arbitrariamente A, las ecuaciones que describen los cambios dinámicos en las cantidades de reactante A en cada tanque son (con unidades de kg . mol de A/min)
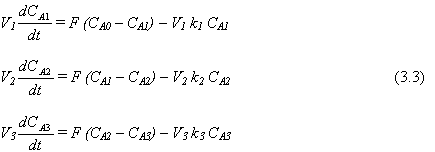 |
La velocidad de reacción específica kn está dada por la ecuación de Arrhenius
si las temperaturas en los reactores son diferentes, los k son diferentes. La n se refiere al número de la etapa.
El volumen Vn puede ser sacado fuere de la derivada del tiempo debido a que es constante (ver Sec. 3.3). los flujos son todos iguales a F pero pueden variar con el tiempo. No es necesaria una ecuación de energía debido a que se ha asumido operación isotérmica. Cualquier cantidad de calor adicionado o removido para mantener los reactores a temperaturas constantes puede calcularse a partir de un balance de energía al estado estacionario (derivada de la temperatura con respecto al tiempo igual a cero).
Las tres ecuaciones diferenciales de primer orden no lineales dadas en la Ecs. (3.3) son el modelo matemático del sistema. Los parámetros que deben ser conocidos son: V1 , V2 V3 , k1 , k2 y k3.. las variables que deben especificarse entes de resolver estas ecuaciones son F y CA0. “Especificada” no significa que debe ser constante. Elles pueden variar con el tiempo, pero deben ser conocidas o dadas como funciones del tiempo. Ellas son las funciones impulsoras.
Las condiciones iniciales de las tres concentraciones (sus valores en el tiempo igual a cero) también se deben conocer.
Verificando ahora los grados de libertad del sistema. Existen tres ecuaciones y, con los parámetros y funciones impulsoras especificadas, existen solamente tres incógnitas o variables dependientes: CA1, CA2, y CA3. Consecuentemente puede ser posible una solución, tal como se verá en el Cáp. 5.
Usaremos este sistema simple en muchas partes subsecuentes de este libro. Si se usa para diseño de sistemas de control y para análisis de estabilidad, se usará una versión simplificada. Si el flujo F es constante y las retenciones y temperaturas son las mismas en todos los tanques, las Ecs (3.3) serán
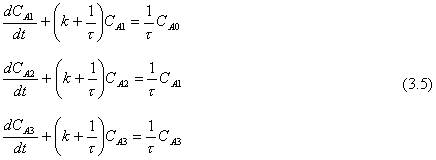 |
donde t = V/F con unidades de minutos
Existe solamente una función impulsora o variable de entrada CA0.
3.3 CSTRs CON RETENCIÓN VARIABLE
Si el ejemplo anterior se modifica para permitir que el volumen de cada reactor varíe con el tiempo, se requieren las ecuaciones de continuidad total y por componente para cada reactor. Para mostrar los efectos de una cinética de alto orden, asumimos ahora que la reacción es de orden n con respecto a A.
Reactor 1:
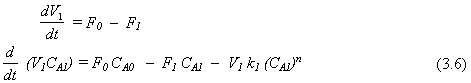
Reactor 2:
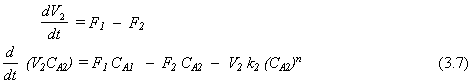
Reactor 3:
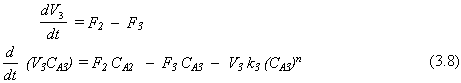
El modelo matemático ahora contiene seis ecuaciones diferenciales ordinarias de primer orden no lineales. Los parámetros que deben ser conocidos son k1 , k2 , k3 y n. Se deben dar las condiciones iniciales de todas las variables que deben integrarse: CA1 , CA2 , CA3 , V1 , V2 y V3 . Las funciones impulsoras CA0(T) y F0(T) también se deben dar.
Verificando ahora los grados de libertad de este sistema. Hay seis ecuaciones. Pero hay nueve incógnitas: CA1 , CA2 , CA3 , V1 , V2 , V3 , F1 , F2 y F3. Claramente, este sistema no esta suficientemente especificado u no podría obtenerse una solución.
En que se ha fallado en el modelamiento?.
Un buen operador de planta podría dar una mirada al sistema y ver cual es el problema. Nosotros no hemos especificado como serán los flujos de salida de los tanques. Físicamente estos pueden regularse mediante válvulas de control colocadas en la salida de los tanques. Como actuarán estas válvulas de control?.
Una configuración común es mantener el nivel en el tanque controlado por el flujo de salida, por ejemplo un controlador de nivel abre la válvula de control en la línea de salida para incrementar el flujo de salida si el nivel en el tanque se incrementa. Por lo tanto debe existir una relación entre la retención en el tanque y el flujo.
![]()
La función f describe al controlador de nivel y a la válvula de control. Estas tres relaciones reducen los grados de libertad a cero.
Podríamos considerar el flujo desde el tercer tanque F3 como la función impulsora. Luego el nivel en el tanque 3 probablemente podría mantenerse por el flujo de entrada al tanque, F2. El nivel en el tanque 2 podría controlarse con F1, y el nivel en el tanque 1 mediante F0. Con esto podemos tener tres ecuaciones.
Los reactores mostrados en la Fig. 3-1 pueden operar a presión atmosférica si ellos están abiertos a la atmósfera. Si los reactores están cerrados y no contienen inertes, podrían operar a la presión del punto de burbuja a la temperatura específica y la composición variada. Entonces la presión puede ser diferente en cada reactor, y esta puede variar con el tiempo, aún cuando las temperaturas se asuman constantes, así las CA’s varían.
3.4 DOS TANQUES CALENTADOS
Ahora nuestro siguiente ejemplo considerará un proceso en el cual son necesarios dos balances de energía para modelar el sistema. El flujo F de aceite pasando de dos tanques en serie perfectamente mezclados es constante e igual a 90 pies3/min. La densidad r del aceite es constante e igual a 40 lbm/ pie3, y su capacidad calorífica CP es 0,6 Btu/lbm°F. El volumen del primer tanque V1 es constante e igual a 450 pies3, y el volumen del segundo tanque V2 es constante e igual a 90 pies3. La temperatura del aceite entrando al primer tanque es T0 y es 150 °F en el estado estacionario inicial. Las temperaturas en los dos tanques son T1 y T2. Las dos son iguales a 250 °F en el estado estacionario inicial. Un dispositivo de calentamiento en el primer tanque usa vapor para calentar el aceite. Denominando Q1 al calor adicionado en el primer tanque.
Se puede hacer un balance de energía para cada tanque, y cada una será similar a la Ec. (2.26) excepto que no hay reacción involucrada en este proceso.
Balance de energía para el tanque 1:
![]()
Balance de energía para el tanque 2:
![]()
Como el flujo a través de los tanques es constante F0 = F1 = F2 = F. Debido a que los volúmenes, densidades, y capacidades caloríficas son todas constantes, las Ecs. (3.10) y (3.11) se pueden simplificar
Verificando los grados de libertad de este sistema. Los valores de los parámetros que son conocidos son r , CP , V1, V2, y F. La entrada de calor al primer tanque Q1 se podría fijar con la posición de la válvula de control en le línea de vapor. Entonces se tienen dos variables dependientes T1, y T2, y también dos ecuaciones, por lo tanto el sistema está correctamente especificado
3.5 REACTOR CSTR EN FASE GAS A PRESIÓN
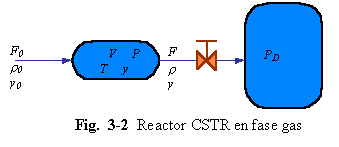
Considerar una mezcla de gases, la cual es alimentada al reactor mostrado en la Fig. 3-2. El reactor está lleno con gases reaccionantes los cuales están perfectamente mezclados. Ocurre una reacción reversible:
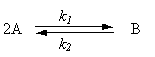
La velocidad de reacción directa es de orden 1,5 con respecto a A; la reacción inversa es de primer orden con respecto a B. Notar que el coeficiente estequiometrico para A y el orden de la reacción no son los mismos. La fracción molar de reactante A en el reactor es y. La presión dentro del recipiente es P (absoluta). Tanto P como y pueden variar con el tiempo. El volumen V del reactor es constante.
Asumiendo un sistema isotérmico, se tendrá que la temperatura T es constante. También se asume comportamiento del gas perfecto. La corriente de alimentación tiene una densidad r0 y una fracción molar y0 de reactante A. Su flujo volumétrico es F0.
El flujo de salida del reactor pasa a través de una restricción (válvula de control) y entra a otro tanque el cual se mantiene a presión constante P0 (absoluta). El flujo de salida varía con la presión y la composición en el reactor. Los flujos pasando a través de la válvula de control son discutidos con más de talle en los textos sobre control automático de procesos: aquí usamos la fórmula
Cv = es el coeficiente de válvula. La densidad varía con la presión y la composición
![]()
donde M = peso molecular promedio
MA = peso molecular del reactante A
MB = peso molecular del producto B
La concentración de reactante en el reactor es
![]()
Con unidades de moles de A por unidad de volumen. La velocidad total de reacción directa es
![]()
La velocidad de reacción total para la reacción inversa es
![]()
Con estas relaciones fundamentales se pueden escribir las ecuaciones de continuidad total y por componente
Total de continuidad:
De continuidad por componente:
![]()
El número 2 en los términos de las reacciones proviene del coeficiente estequiométrico de A.
Existen cinco ecuaciones (Ecs. 3.14) hasta (3.18) que conforman el modelo matemático del sistema. Los parámetros que deben ser conocidos son V, Cv, k1, k2, R, MA, y MB. Las funciones impulsoras (o entradas) pueden ser PD , ro , Fo , y CAo . Con lo cual se tienen cinco incógnitas (variables dependientes): CA, r , P, F , y y.
3.6 CSTR NO ISOTÉRMICO
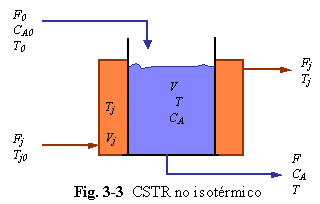
En los reactores estudiados antes, hemos mostrado los efectos de las variaciones de retención (volumen), variaciones de densidades y cinéticas de alto orden sobre las ecuaciones de continuidad total y por componente. No son necesarias las ecuaciones de energía debido a que se han asumido operaciones isotérmicas. Ahora consideraremos un sistema en el cual la temperatura cambia con el tiempo. Una reacción irreversible exotérmica es llevada a cabo en un reactor CSTR simple perfectamente mezclado como se muestra en la Fig. 3-3.
![]()
La reacción es de orden n con respecto al reactante A y tiene un calor de reacción l (Btu/lb . mol de A reaccionado) . Se asume densidad constante y pérdidas de calor despreciables.
El calor de reacción se remueve mediante una chaqueta. A la chaqueta se adiciona agua de enfriamiento a un flujo volumétrico de Fj y con una temperatura de entrada de T0j. El volumen de agua en la chaqueta Vj es constante. La masa de la pared metálica se asume despreciable por lo cual no se considera la “inercia térmica” de la pared metálica. Esto es a menudo una buena asunción ya que la capacidad calorífica del acero es alrededor de solamente 0,1 Btu/lbm °F, la cual es en orden de magnitud menor que la del agua.
A. CHAQUETA DE ENFRIAMIENTO PERFECTAMENTE MEZCLADA. Asumimos que la temperatura en cualquier punto de la chaqueta es Tj. La transferencia de calor entre el proceso a temperatura T y el agua de enfriamiento de la chaqueta a temperatura Tj se describe por un coeficiente total de transferencia de calor.
Q = U AH (T – Tj ) (3.19)
donde Q = velocidad de transferencia de calor
U = coeficiente total de transferencia de calor
AH = área de transferencia de calor
En general, el área de transferencia de calor puede variar con la retención en el reactor si alguna porción de área no está totalmente cubierta con masa de liquido reaccionante en cualquier tiempo. Las ecuaciones que describen el sistema son
Total de continuidad para el reactor:
![]()
De continuidad por componente para el reactor:
![]()
Ecuación de energía para el reactor:
![]()
Ecuación de energía para la chaqueta:
![]()
donde rj = densidad del agua de enfriamiento
h = entalpía del fluido de proceso
hj = entalpía del agua de enfriamiento
La asunción de densidad constante hace que Cp = Cv y nos permite usar entalpías en las derivadas con respecto al tiempo para reemplazar las energías internas.
También es necesaria una relación hidráulica entre la retención en el reactor y el flujo de salida del reactor. Se asume que un controlador de nivel cambia el flujo a medida que el volumen en el tanque aumenta o disminuye: para volumen grande, el flujo de salida aumenta. El flujo de salida es cortado completamente cuando el volumen cae a un valor mínimo Vmin.
F = KV (V – Vmin) (3.22)
El controlador de nivel es un controlador proporcional con retroalimentación.
Finalmente necesitamos datos de entalpía para relacionar las h’s a las composiciones y temperaturas. Para esto asumimos la forma simple
h = CP T y hj = Cj Tj (3.23)
donde CP = capacidad calorífica del liquido de proceso
Cj = capacidad calorífica del agua de enfriamiento
Usando las Ecs. (3.23) y la relación de Arrhenius para k, las cinco ecuaciones que describen al proceso son:
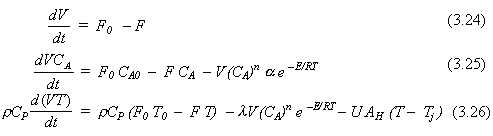
Verificando los grados de libertad, vemos que hay cinco ecuaciones y cinco incógnitas V, F, CA, T y Tj. Debemos tener las condiciones iniciales para estas cinco variables dependientes. Las funciones impulsoras son T0, F0, CA0, y Fj.
Los parámetros que deben ser conocidos son n, a, e, R, r, CP, U, AH, rj, Vj, Cj, Tj0, KV, y Vmin. Si el área de transferencia varía con la retención en el reactor se podría incluir como otra variable, pero también podemos tener otra ecuación; la relación entre área y retención. Si el reactor es un cilindro vertical con diámetro D y si la chaqueta está colocada solamente sobre las paredes laterales, no sobre el fondo
![]()
Hemos asumido que el coeficiente total de transferencia de calor U es constante. Este puede ser una función de la razón de flujo del medio de enfriamiento Fj o la composición de la masa reaccionante, dando una o más variables pero solamente una ecuación.
B. FLUJO EN PISTON DEL REFRIGERANTE EN LA CHAQUETA. En el modelo derivado anteriormente, el agua de enfriamiento dentro de la chaqueta se ha sumido a estar perfectamente mezclado. En muchas chaquetas de recipientes esta no es particularmente una buena asunción. Si la velocidad de flujo del agua es alta, la temperatura del agua no cambia mucho a medida que esta pasa a través de la chaqueta, el patrón de mezcla hace una pequeña diferencia. Sin embargo, si la temperatura del agua se eleva significantemente y si el flujo se acerca mas a un flujo en pistón que a uno perfectamente mezclado (este podría ser claramente el caso de usar un dispositivo de enfriamiento dentro del reactor en lugar de una chaqueta), por lo tanto debe usarse una temperatura promedio para la chaqueta TjA.
![]()
donde Tjsal es la temperatura del agua de enfriamiento
La temperatura promedio se usa en la ecuación para la transferencia de calor y para representar la temperatura del material de la chaqueta. La Ecuación (3.27) será
![]()
La Ec. (3.31) se integra para obtener TjA en función del tiempo, y la Ec. (3.30) se usa para calcular Tjsal, también como una función del tiempo.
C. MODELO DE CHAQUETA POR SECCIONES. Otra alternativa es considerar al volumen de la chaqueta seccionado en partes perfectamente mezcladas como muestra la Fig. 3-4.
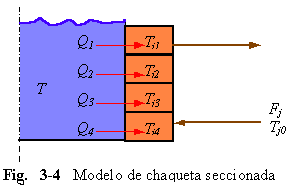
Una ecuación de energía es necesaria para cada sección. Asumiendo cuatro secciones de igual volumen e igual área de transferencia de calor, podemos formular cuatro ecuaciones de energía para la chaqueta:
D. CAPACITANCIA DE LA PARED METÁLICA SIGNIFICATIVA. En algunos reactores, particularmente en recipientes a alta presión, o equipos a pequeña escala, la masa de la pared metálica se debe considerar la masa de la pared metálica y sus efectos sobre la dinámica térmica. Para ser rigurosos, la ecuación de energía para la pared debería ser una ecuación de derivadas parciales con respecto al tiempo y la posición radial. Una aproximación menos rigurosa pero frecuentemente usada, es “separar” la masa de la pared del metal y asumir que el metal está todo a una temperatura TM. Esta asunción es buena cuando la pared no tiene mucho espesor y la conductividad del metal no es muy grande.
Además usando los coeficientes de película interior y exterior hi y h0 como muestra la Fig. 3-5.
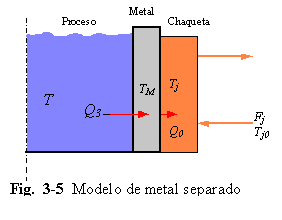
Las tres ecuaciones para el proceso son:
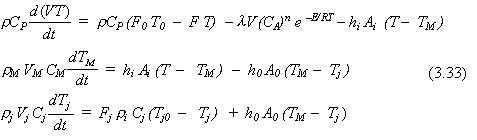
donde hi = coeficiente de película interior
h0 = coeficiente de película exterior
rM = densidad de la pared metálica
VM = volumen de la pared metálica
CM = capacidad calorífica de la pared del metal
Ai = área de transferencia de calor interior
A0 = área de transferencia de calor exterior
3.7 VAPORIZADOR DE UN COMPONENTE SIMPLE
Los sistemas en ebullición representan algunas de las operaciones más importantes e interesantes en procesos de ingeniería química y son más difíciles de modelar. Para describir rigurosamente estos sistemas, se deben escribir las ecuaciones de conservación para ambas fases, vapor y liquido. El problema principal es encontrar la velocidad de vaporización del material desde la fase liquida hacia la fase vapor. Las ecuaciones usadas para describir la velocidad de ebullición deben ser físicamente razonables y matemáticamente convenientes para su solución.
Considerar el vaporizador mostrado en la Fig. 3-6. Gas licuado de petróleo (LPG) es alimentado a un tanque presurizado para mantener el nivel de liquido en el tanque. Asumiremos que el LPG es un componente puro: propano. Vaporización de mezclas de componentes se discute en la Sec. 3.8.
El liquido en el tanque se asume como perfectamente mezclado. Calor es adicionado a una velocidad Q para mantener la presión deseada en el tanque mediante la vaporización del liquido a la velocidad Wv (masa por tiempo). Se asumen despreciables las pérdidas de calor y la masa de la pared del tanque. El gas es evacuado fuera del tanque por el tope a un flujo volumétrico Fv. Fv es la función impulsora o carga perturbadora.
A. UN MODELO AL ESTADO ESTACIONARIO. El modelo más simple podría
despreciar las dinámicas de las fases vapor y liquido, y relacionar la velocidad del gas Fv a la entrada de calor mediante
rv Fv (Hv – h0 ) = Q (3.34)
donde Hv = entalpía del vapor saliendo del tanque (Btu/lbm o cal/g)
h0 = entalpía del liquido alimentado (Btu/lbm o cal/g)
B. MODELO CON DINAMICA DE EQUILIBRIO DE FASES. Un modelo más realista se obtiene si asumimos que el volumen de la fase vapor es pequeño con lo cual podemos hacer despreciable su dinámica. Si solamente unos pocos moles de liquido tienen que ser vaporizados para cambiar la presión en la fase vapor, podemos asumir que esta presión es siempre igual a la presión de vapor del liquido a cualquier temperatura del sistema (P = Pv y Wv = rv Fv). Una ecuación de energía para la fase liquida da la temperatura (como una función del tiempo), y las relaciones de presión de vapor darán la presión en el vaporizador a esa temperatura.
Una ecuación de continuidad total para la fase liquida también es necesaria, además de las ecuaciones de los dos controladores relacionando la presión a la entrada de calor y el nivel de liquido al flujo de alimentación Fo. Estas relaciones del controlador de retroalimentación se expresarán aquí simplemente como una función. En los tópicos sobre control se discuten estas funciones con detalle.
Q = f1(P) F0 = f2(VL) (3.35)
Para poder calcular la densidad rv a partir de la temperatura o presión, es necesario una ecuación de estado para el vapor. Conociendo cualquiera de las propiedades (T, P, o rV) se pueden tener todas las demás propiedades ya que este es solamente un componente, y están presentes dos fases en el tanque. Se usa la ley del gas perfecto.
Se asume que el liquido es incompresible de tal manera que Cv = CP y su energía interna es CPT. La entalpía del vapor saliendo del vaporizador es asumida a ser de la simple forma: CPT + l v.
Ecuación de continuidad total:
Ecuación de energía:
![]()
Ecuación de estado:
![]()
Presión de vapor
Las ecuaciones (3.35) a (3.39) nos dan seis ecuaciones. Las incógnitas son Q, F0, P, VL, rv, y T.
C. MODELO CON DINAMICA DE LIQUIDO Y VAPOR. Si la dinámica de la fase vapor no puede despreciarse (cuando se tiene una volumen grande de vapor), se deben escribir las ecuaciones total de continuidad y de energía para el gas dentro del tanque. El vapor saliendo del tanque, rvFv, no es exactamente igual, dinámicamente, a la velocidad de vaporización Wv.
La clave del problema es ahora encontrar una expresión simple y razonable para la velocidad de ebullición Wv. Se ha encontrada en otras simulaciones que un tipo de ecuación de “transferencia de masa” puede ser convenientemente empleada. Estas relaciones también deben darle el sentido físico. Un liquido hierve debido, a la misma temperatura (y composición si esta presente mas de un componente), si ejerce una presión de vapor P más grande que Pv en la fase vapor sobre él. Esta diferencial de presión es la fuerza impulsora
Wv = KMT (P – Pv) (3.40)
Donde KMT es el seudo coeficiente de transferencia de masa. Naturalmente en el equilibrio (no en el estado estacionario) P = Pv. Si asumimos que el liquido y el vapor están en equilibrio, podemos decir que KMT es muy grande. Cuando las ecuaciones son resueltas en una computadora, se pueden usar diferentes valores de KMT para examinar los efectos de las condiciones de no equilibrio.
Las ecuaciones que describen este sistema son:
Fase liquida
De continuidad total
![]()
De energía:
Presión de vapor
![]()
Fase vapor
De continuidad total
De energía:
![]()
De estado
donde UL = energía interna del liquido a temperatura T
HL = entalpía del vapor saliendo del liquido
Uv = energía interna del vapor a temperatura Tv
Hv = entalpía de la fase vapor.
Son necesarios datos de propiedades térmicas para relacionar las entalpías a las temperaturas. Podemos ver que hay 10 variables Q, F0 ,VL , Wv , T, Vv , rv , Tv ,P, y Pv.
Contando las Ecs. (3.35) y (3.40) hasta (3.46) vemos que hay solamente nueve ecuaciones. Algo esta faltando. Un análisis posterior puede generar la otra relación, la restricción física: VL + Vv = volumen total del tanque.
D. MODELO DE EQUILIBRIO TERMICO. Los casos previos dan un modelo el cual es riguroso dentro de lo razonablemente esperado. Un modelo final no tan rigurosos pero usualmente adecuado, es uno en el cual se asume equilibrio térmico entre el liquido y el vapor en todo instante. Más simple, se asume que las temperatura del vapor y el liquido son iguales: T = TV . Esto elimina la necesidad de un balance de energía para la fase vapor. Este modelo posiblemente trabaje muy bien debido a que el calor sensible del vapor es usualmente pequeño comparado con los efectos de calor latente.
Si se puede usar la relación simple de entalpía, la Ec. (3.42) será:
![]()
Los modelos simples discutidos anteriormente (tal como los casos A y B) son usualmente lo suficientemente buenos para sistemas de flujo continúo donde los cambios en las retenciones y temperaturas del liquido y vapor no son muy grandes. Los sistemas “batch” pueden requerir los modelos más rigurosos (casos C y D) debido a que hay gran variación de la mayoría de variables.
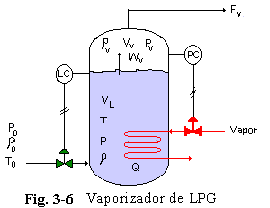
3.8 EVAPORACIÓN “FLASH” DE MULTIPLECOMPONENTES
Veamos ahora un sistema liquido-vapor con más de un componente. Una corriente liquida a alta temperatura y presión es “flasheada” hacia un tanque; antes, su presión se reduce a medida que el flujo pasa por una restricción (válvula) a la entrada del tanque. Esta expansión súbita es irreversible y ocurre a entalpía constante. Si fuese una expansión reversible podría conservarse la entropía (y no la entalpía). Si la presión en el tanque es menor que la presión del punto de burbuja de la alimentación a la temperatura de alimentación, algo de liquido alimentado se vaporizará.
El gas es evacuado por el tope del recipiente a través de una válvula de control cuya posición del vástago es regulada por la presión del controlador (Fig. 3-7). El liquido sale por el fondo del tanque mediante un control de nivel.
Fig. 3-7 Tanque “Flash”
La presión P0 antes de la válvula es tan alta que evita cualquier vaporización de la alimentación a la temperatura T0 y composición x0j (fracción molar del componente j). Se asumen condiciones adiabáticas (sin pérdida de calor). La densidad del liquido en el tanque, r L, se asume que es una función de la temperatura y composición.
rL = f(x j , T) (3.48)
La densidad rv del vapor en el tanque es una conocida función de la temperatura T, composición yj y presión P. Si se usa la ley del gas perfecto,
![]()
donde ![]() es el peso molecular promedio del gas.
es el peso molecular promedio del gas.
donde Mj es el peso molecular del componente j.
A. MODELO DE ESTADO ESTACIONARIO
El modelo más simple de este sistema es uno en el cual se desprecie completamente la dinámica. se asume presión constante, y se usan las ecuaciones de continuidad total y por componente al estado estacionario y un balance de energía al estado estacionario. Se asumen que las fases de vapor y liquido están en equilibrio.
De continuidad total
r0 F0 = rv Fv + rv FL (3.51)
De continuidad por componente
Equilibrio liquido – vapor
yi = f(xj , T , P) (3.53)
Ecuación de energía
r0 F0 h0 = H rv Fv + rL FL h (3.54)
Propiedades termodinámicas
h0 = f(x0j , T0) h = f(xj , T) H = f(xj , T , P) (3.55)
Los pesos moleculares promedio en cada corriente Mav se calculan a partir de las fracciones molares en las corrientes [Ver Ec. (3.50)]. El número de variables en el sistema es 9 + 2 (NC – 1) : rv , Fv , MavV , y1 , y2 , . . . yNC -1 , rL , FL , MavL , x1 , x2 , . . . xNC -1 , T , h, y H. La presión P y todas las propiedades de la alimentación son dadas. Hay NC – 1 balances de componentes [Ec. (3.52)].
Ecuación |
Número de Ecuaciones | |
| De continuidad total | (3.51) | 1 |
| Energía | (3.54) | 1 |
| De continuidad por componente | (3.52) | NC – 1 |
| Equilibrio liquido – vapor | (3.53) |
NC |
| Densidades de vapor y liquido | (3.48) y (3.49) | 2 |
| Propiedades térmicas para las corrientes de vapor y liquido | (3.55) | 2 |
| Pesos moleculares promedios | (3.50) | 2 |
| TOTAL | 2NC + 7 |
2NC +Hay un total de NC ecuaciones de equilibrio. Podemos decir que hay NC ecuaciones semejantes a la Ec. (3.53). esto puede incomodar algo a Ud. Como la suma de las y’s es igual a 1, se puede decir que hay solamente NC – 1 ecuaciones para las y’s. Pero aún si se piensa que este es el camino, el tanque proporciona una ecuación más. La suma de las presiones parciales es igual a la presión total, también hay NC ecuaciones de equilibrio de fases.
El sistema se especifica con el conjunto de ecuaciones algebraicas listadas anteriormente. Este es solamente el tradicional calculo de un tanque “flash” al estado estacionario.
B. MODELO RIGUROSO. La dinámica puede incluirse por diferentes caminos, con variación de grados de rigor, con el uso de modelos similares a los dados en la Sec. 3.7. Ahora indicaremos como podría desarrollarse un modelo rigurosos, similar al caso C de la Sec. 3.7. La Fig. 3-8, muestra esquemáticamente el sistema.
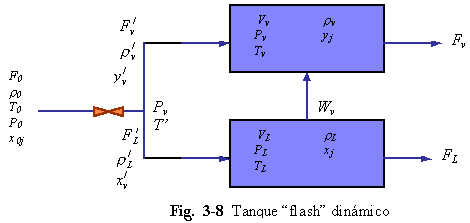
Un cálculo de equilibrio “flash” (usando las mismas ecuaciones del caso A anterior) es realizado a cada punto en el tiempo para encontrar las velocidades de flujo de vapor y liquido y propiedades inmediatamente después que la presión cae en la válvula (las variables con primos: ![]() ,
, ![]() ,
, ![]() ,
, ![]() , . . . mostradas en la Fig. 3.8). Estas dos corrientes son luego alimentadas a las fases de liquido y vapor. Las ecuaciones que describen estas dos fases serán similares a las Ecs. (3.40) a (3.42) y (3.44) a (3.46) con la adición de (1) ecuación de equilibrio liquido-vapor de múltiple componentes para calcular r L y (2) NC – 1 ecuaciones de continuidad por componente para cada fase. Las ecuaciones de los controladores relacionando VL a FL y Pv a Fv completan el modelo.
, . . . mostradas en la Fig. 3.8). Estas dos corrientes son luego alimentadas a las fases de liquido y vapor. Las ecuaciones que describen estas dos fases serán similares a las Ecs. (3.40) a (3.42) y (3.44) a (3.46) con la adición de (1) ecuación de equilibrio liquido-vapor de múltiple componentes para calcular r L y (2) NC – 1 ecuaciones de continuidad por componente para cada fase. Las ecuaciones de los controladores relacionando VL a FL y Pv a Fv completan el modelo.
FL = f (VL) Fv = f(Pv) (3.56)
C. MODELO PRACTICO. Un modelo dinámico más trabajable puede ser desarrollado si ignoramos la dinámica de la fase vapor (tal como hemos indicado en el caso B de la sec. 3.7). Se asume que el vapor siempre está en equilibrio con el liquido. Las ecuaciones de conservación son escritas solamente para la fase liquida.
De continuidad total
![]()
De continuidad por componente
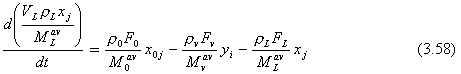
Energía
![]()
Las NC ecuaciones de equilibrio liquido-vapor [Ecs. (3.53)], las tres relaciones de entalpía [Ecs. (3.55)], las dos ecuaciones de densidad [Ecs. (3.48) y (3.49)], las dos ecuaciones de pesos moleculares [Ec. (3.50)], y las ecuaciones de los controladores de retroalimentación [Ecs. (3.56)] son todas necesarias. El número total de ecuaciones es 2NC + 9, las cuales son iguales al número total de variables: Pv , VL , rv , Fv , M avv , y1 , y2 , . . . yNC-1 , rL , FL , MavL, x1 , x2 , . . . xNC-1 , T, h y H.
Teniendo en cuenta que son dadas todas las propiedades de alimentación, o funciones impulsoras: r0 , F0 . h0 , xj0 , y MavD.
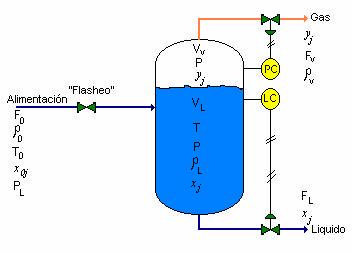
3.9 REACTOR “BATCH”
Los procesos “batch” ofrecen algunos de los más interesantes y cambiantes problemas en modelamiento y control debido a su naturaleza dinámica inherente.
Aún cuando la mayoría de los procesos químicos a gran escala han sido operados de manera continua, muchos procesos “batch” se siguen usando en la producción de pequeños volúmenes, especialmente de productos farmacéuticos. Los reactores “batch” tienen ventajas cinéticas inherentes sobre los reactores continuos para la mayoría de reacciones (principalmente para constantes de velocidad bajas). El extenso uso de control digital de procesos mediante las computadoras ha permitido la automatización y optimización de los procesos “batch” y los han hecho más eficientes y menos trabajosos.
Fig. 3.9 Reactor “batch”
Considerando el reactor “batch” mostrado en la Fig. 3-9. El reactante es cargado en el recipiente. Vapor es alimentado hacia la chaqueta para elevar la temperatura de los reactantes a un valor deseado. Posteriormente se debe adicionar agua de enfriamiento a la chaqueta para remover el calor de la reacción exotérmica y hacer que la temperatura del reactor siga la curva establecida de temperatura – tiempo. El perfil de temperatura es alimentado al controlador de temperatura como una señal de referencia (“set point”) el valor de referencia varía con el tiempo.
En el reactor se lleva a cabo en este tiempo una reacción consecutiva de primer orden.
![]()
El producto que deseamos obtener es el componente B. Si dejamos que la reacción prosiga por mucho tiempo, mucho B reaccionará para formar C; con lo cual el rendimiento será bajo. Si detenemos la reacción, claramente poco A habrá reaccionado; por lo tanto la conversión y el rendimiento serán bajos. Entonces habrá un tiempo óptimo de “batch” al cual podemos detener la reacción.
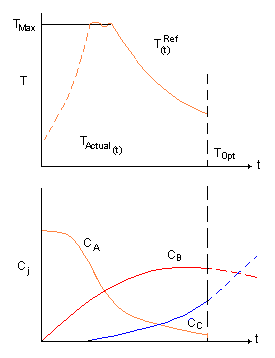
Fig. 3-10 Perfiles en un “batch”
También habrá un perfil óptimo de temperatura, si las dependencias de la temperatura de las velocidades específicas de reacción k1 y k2 son las mismas (si sus energías de activación son iguales), la reacción podría llevarse a cabo a la temperatura más alta posible para minimizar el tiempo de “batch”. Esta temperatura máxima podría tener un límite impuesto por alguna restricción : máxima temperatura de trabajo o presión del equipo, posteriores degradaciones indeseables o polimerización de productos o reactantes a temperaturas muy altas, etc.
Si k1 es más dependiente de la temperatura que k2, podemos otra vez llevar a cabo la reacción a la temperatura más alta posible para favorecer la reacción a B. En ambos casos debemos detener la reacción a un tiempo grande de tal manera que se pueda recuperar la máxima cantidad de B.
Si k1 es menos dependiente de la temperatura que k2, el perfil óptimo de temperatura es el que se inicia a una temperatura alta para conseguir que la primera reacción proceda pero luego caiga para evitar la pérdida de mucho B. La Fig. 3-10 muestra los perfiles óptimos de temperatura y concentración. La Fig. 3-10 también muestra como la línea discontinúa es un ejemplo de una temperatura actual que podría ser alcanzada en un reactor real. La masa de reacción debe ser calentada hasta Tmax. Este perfil de temperatura se usará como la señal de referencia.
Con este razonamiento, derivaremos ahora un modelo matemático para este proceso. Asumiremos que la densidad del liquido de reacción es constante. La ecuación total de continuidad para la masa reaccionante, después que los reactantes han sido cargados y el ciclo del “batch” iniciado, es
No hay flujos de entrada y salida. Como r es constante, dV/dt = 0. Entonces el volumen de liquido en el reactor es constante.
Ecuación de continuidad para el componente A:
Ecuación de continuidad para el componente B:
![]()
Ecuaciones cinéticas:
![]()
Usando un modelo seccionado para la pared metálica del reactor y la ecuación simple de la entalpía h = CP T, las ecuaciones de energía para el liquido reaccionante y la pared metálica son:
Ecuación de energía para el proceso:
Ecuación de energía para la pared metálica:
![]()
donde l1 y l2 son los calores de reacción exotérmicos para las dos reacciones.
Notar que cuando el reactor es calentado con vapor, Tj es más grande que TM , y TM es más grande que T. Cuando se enfría con agua, los diferenciales de temperatura tienen el signo opuesto. Tener presente también que el coeficiente de película exterior h0 es usualmente significativamente diferente para vapor condensando y para agua de enfriamiento circulando.
Este cambio desde el calentamiento a enfriamiento es una significativa operación, particularmente si se quiere alcanzar Tmax tan rápido como sea posible, pero sin sobrepasarlo. Un sistema comúnmente usado es mostrado en la Fig. 3.9. el controlador de temperatura mantiene la válvula de vapor (V-1) abierta y la válvula de agua de enfriamiento (V-2) cerrada durante el calentamiento. Esto se consigue con una válvula de porcentajes iguales (ver los tópicos sobre control automático). También durante el calentamiento la válvula de salida del agua de enfriamiento (V-3) es mantenida cerrada y la válvula de condensado (V-4) mantenida abierta.
Cuando se requiere enfriamiento, el controlador cierra la válvula de vapor y abre la válvula de agua de enfriamiento con lo cual se hace que la temperatura del reactor siga el valor de referencia. La válvula (V-3) debe ser abierta y la válvula (V-4) debe cerrarse siempre adicionando agua de enfriamiento.
La simulación y control de este sistema se estudia con detalle en el texto del autor sobre control automático. Aquí simplemente estableceremos que hay una relación conocida entre la señal de error E (o la temperatura de referencia menos la temperatura del reactor) y las velocidades del flujo volumétrico del vapor FS y agua de enfriamiento Fw.
FS = f1(E) Fw = f2(E) (3.66)
Para describir lo que está sucediendo en la chaqueta, podemos necesitar dos conjuntos diferentes de ecuaciones, dependientes de la etapa: calentamiento o enfriamiento. Podemos aún considerar una tercera etapa: llenado de la chaqueta con agua de enfriamiento. Si la velocidad de flujo del agua de enfriamiento es grande y/o el volumen de la chaqueta es pequeño, el tiempo de llenado de la chaqueta puede ser despreciable.
A. FASE DE CALENTAMIENTO. Durante el calentamiento, se necesitan una ecuación de continuidad total y una ecuación de energía para el vapor, además de una ecuación de estado para el vapor.
De continuidad total:
donde Vj = volumen de la chaqueta
rj = densidad del vapor dentro de la chaqueta
rS = densidad del vapor a la entrada de la chaqueta
WC = velocidad de condensación del vapor (masa por tiempo)
Se asume que el liquido condensado es inmediatamente evacuado a través de la trampa de vapor.
Ecuación de energía para el vapor:
donde Uj = energía interna del vapor en la chaqueta
HS = entalpía del vapor de entrada
hc = entalpía del liquido condensado
Los cambios de energía interna (efectos de calor sensible) pueden usualmente despreciarse comparados con los efectos de calor latente. Luego puede usarse una ecuación algebraica simple al estado estacionario
Se pueden usar tanto la ecuación de estado para el vapor o las tablas de vapor para calcular la temperatura Tj y la presión Pj a partir de la densidad rj. Por ejemplo si se usa la ley del gas perfecto se puede usar una ecuación de vapor simple.

donde M = peso molecular del vapor = 18
Aw y Bw = constantes de presión de vapor para agua
La Ec. (3.70) puede resolverse iterativamente para Tj si se conoce rj [a partir de la Ec. (3.67)]. Cuando se conoce Tj, se puede calcular Pj a partir de una ecuación de presión de vapor. Es usualmente necesario conocer Pj en orden a calcular la velocidad de flujo del vapor a través de la válvula de entrada a partir del efecto de la velocidad sobre la caída de presión a través de la válvula (aún cuando el flujo a través de la válvula es “crítico”).
Si la masa del metal alrededor de la chaqueta es significante, se requiere para una ecuación de energía. En este caso asumiremos despreciable.
En la mayoría de reactores con chaqueta o rehervidores calentados con vapor, el volumen ocupado por el vapor es muy pequeño comparado con la velocidad del flujo volumétrico del vapor. Entonces la respuesta dinámica de la chaqueta es usualmente muy rápida, y a menudo se pueden usar balances simples de masa y energía. La velocidad de flujo del vapor debe establecerse igual a la velocidad de flujo del condensado, el cual es calculado mediante la solución iterativa de las relaciones de transferencia de calor para el sistema (Q = U A D T) y la ecuación de flujo de la válvula para la presión de entrada de la chaqueta y la velocidad de flujo del condensado.
B. FASE DE ENFRIAMIENTO. Durante el periodo cuando está fluyendo el agua de enfriamiento a través de la chaqueta. Solamente se requiere una ecuación de energía para la chaqueta si se asume que la chaqueta esta perfectamente mezclada.
donde Tj = temperatura del agua de enfriamiento dentro de la chaqueta
rj = densidad del agua
Cj = capacidad calorífica del agua
Tj0 = temperatura de entrada del agua de enfriamiento
Verificando los grados de libertad del sistema durante la etapa de calentamiento se tienen siete variables (CA , CB , T, TM , Tj, rj y Wc ) y siete ecuaciones [ Ecs. (3.61), (3.62), (3.64), (3.65), (3.67), (3.69), y (3.70)]. Durante la etapa de enfriamiento usamos la Ec. (3.71) en lugar de las Ecs. (3.67), (3.69) y (3.70), pero tenemos solamente Tj en lugar de Tj , rj y Wc.
3.10 REACTOR CON TRANSFERENCIA DE MASA
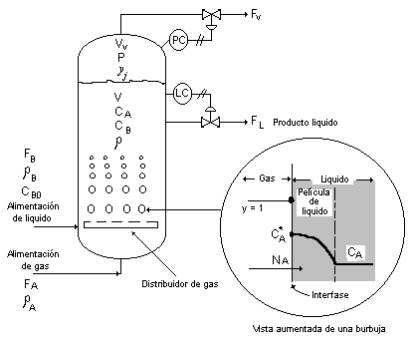
Como se ha indicado en nuestras discusiones anteriores sobre cinética en el Cáp. 2, los reactores químicos algunas veces tienen limitaciones de transferencia de masa tanto como limitaciones de velocidad de reacción. La transferencia de masa puede ser una limitación cuando se mueve de una fase a otra, antes de llevarse a cabo la reacción. Como un ejemplo de este fenómeno, consideraremos el reactor mostrado en la Fig. 3.11, en el cual se burbujea un gas a través de un liquido.
Reactante A es alimentado como un gas a través de un distribuidor por el fondo del reactor llenado con liquido. Una reacción química ocurre entre A y B en la fase liquida para formar un producto liquido C. El reactante A debe disolverse en el liquido antes de poder reaccionar.
Si la velocidad de transferencia de masa del gas A al liquido es baja, la concentración de A en el liquido será baja ya que este es consumido por la reacción tan rápido como llega. Entonces el reactor es limitado por la transferencia de masa.
Fig. 3-11 Reactor con burbujeo de gas en liquido
Si la velocidad de transferencia de masa del gas hacia el liquido es rápida, la concentración de reactante A se mantendrá sobre un valor dado por las condiciones de reacción al estado estacionario y la solubilidad de equilibrio de A en el liquido. El reactor es limitado por la reacción química.
Notar que en la región limitada por la transferencia de masa, incrementando o reduciendo la concentración del reactante B se tendrá pequeña diferencia en la velocidad de reacción (o la productividad del reactor) debido a que la concentración de A en el liquido es siempre muy pequeña. De otro modo, incrementando la temperatura del reactor no dará un incremento exponencial en la velocidad de reacción. La velocidad actual de reacción puede disminuir con el incremento de la temperatura debido a una disminución de la solubilidad de equilibrio de A en la interfase liquido-gas.
Ahora trataremos de describir algunos de estos fenómenos cuantitativamente. Por simplicidad asumiremos operación isotérmica, con retención constante, presión constante, densidad constante y una fase liquida perfectamente mezclada. Las burbujas de gas alimentado se asumen a ser componente puro A, el cual da una concentración de equilibrio constante de A en la interfase liquido-gas igual a CA* (esta podría cambiar si la presión y la temperatura no son constantes). El área total de transferencia de masa de las burbujas es AMT y depende de la velocidad de alimentación de gas FA. Un coeficiente de transferencia de masa constante kl (con unidades de longitud por tiempo) es usado para dar el flujo (“flux”) de A hacia el liquido a través de la película de liquido como una función de la fuerza impulsora.
NA = kl (CA* – CA ) (3.72)
La transferencia de masa usualmente es limitada por la difusión a través de la película de liquido debido a las bajas difusividades del liquido.
![]()
Ecuación de continuidad para el componente A:
Ecuación de continuidad para el componente B:
![]()
De continuidad total:
Las ecuaciones (3.72) a (3.76) dan cinco ecuaciones. Las variables son NA , CA , CB , FV , y FL. Las funciones impulsoras son FA , FB , y CB0 .
3.11 COLUMNA IDEAL DE DESTILACIÓN BINARIA
Junto con el reactor CSTR, la columna de destilación es probablemente el proceso más popular e importante estudiado en la literatura de ingeniería química. La destilación es usada en muchos procesos químicos para separación de corrientes de alimentación y para purificación de corrientes finales e intermedias.
La mayoría de columnas manipulan alimentaciones de múltiple componentes. Pero muchas pueden ser aproximadas a mezclas binarias o seudo binarias. Para este ejemplo, sin embargo, haremos varias asunciones severas adicionales e idealizaciones que algunas veces son válidas pero frecuentemente son solamente crudas aproximaciones.
El propósito de estudiar este caso primero es para reducir el problema a su forma más elemental de tal manera que pueda ser vista claramente la estructura básica de las ecuaciones. En el siguiente ejemplo será modelado un sistema más realista.
Asumiendo un sistema binario (dos componentes) con volatilidad relativa constante a lo largo de la columna y platos teóricos (100 por ciento de eficiencia), lo que significa que el vapor saliendo del plato está en equilibrio con el liquido sobre el plato. Esto permite que pueda ser usada la relación simple de equilibrio liquido vapor
donde xn = composición del liquido saliendo del plato n (fracción molar del
componente más volátil)
yn = composición del vapor saliendo del plato n (fracción molar del componente más volátil)
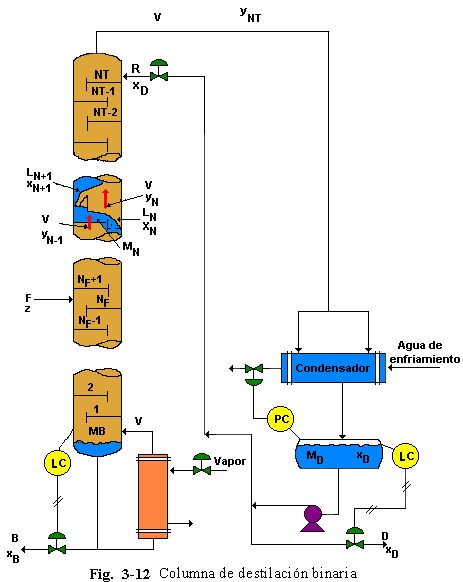
Una corriente simple es alimentada como liquido saturado (a su punto de burbuja) sobre el plato de alimentación NF. Ver Fig. 3-12. El flujo de alimentación es F Mol/min) y su composición es z (fracción molar del componente más volátil). El vapor que sale por el tope es totalmente condensado en un condensador y enviado hacia el tanque de reflujo, donde la retención de liquido es MD (moles). Se asume que el contenido del tanque de reflujo está perfectamente mezclado con composición xD. El liquido en el tanque está a su punto de burbuja. Se bombea reflujo hacia el plato del tope (NT) de la columna a una razón de R. El destilado es removido a razón de D.
Despreciando cualquier retraso en el tiempo (tiempo muerto) en la línea de vapor desde el tope de la columna al tanque de reflujo y en la línea de reflujo hacia el plato del tope (en columnas a escala industrial esta es usualmente una buena asunción, pero no en pequeña escala en columnas de laboratorio). Notar que yNT no es igual, dinámicamente, a xD. Las dos son iguales solamente al estado estacionario.
En la base de la columna, los productos pesados son removidos a razón de B y con una composición xB. El vapor de ebullición es generado en un rehervidor tipo termosifón a razón de V. El liquido circula desde el fondo de la columna a través de los tubos verticales en el rehervidor de casco y tubos debido a la baja densidad de la mezcla liquido-vapor en los tubos del intercambiador. Asumiendo que el liquido en el rehervidor y en la base de la columna son perfectamente mezclados y tienen la misma composición xB y retención total MB (moles). La circulación a través de un rehervidor tipo termosifón bien diseñado es bastante rápida, así, esta asunción es correcta. La composición del vapor saliendo de la base de la columna y entrando al plato 1 es yB. Este está en equilibrio con el liquido cuya composición es xB.
La columna contiene un total de NT platos teóricos. La retención de liquido en cada plato incluyendo el rebose es Mn. El liquido en cada plato es asumido a estar perfectamente mezclado, con composición xn. La retención de vapor es asumida despreciable a lo largo de todo el sistema. Aún cuando el volumen del vapor es grande, el número de moles es usualmente pequeño debido a que la densidad del vapor es mucho más pequeña que la densidad del liquido. Esta asunción no es muy correcta en columnas a alta presión.
Una ulterior asunción es de los flujos equimolares. Si el calor molar de vaporización de los dos componentes son aproximadamente iguales, siempre que condensa un mol de vapor, se vaporiza un mol de liquido. Se asume que las pérdidas de calor desde la columna y los cambios de temperatura de plato a plato (efectos de calor sensible) son despreciables. Estas asunciones permiten que las velocidades de liquido y vapor a través de las secciones de agotamiento y rectificación sean constantes bajo condiciones de estado estacionario. Las líneas de operación sobre el familiar diagrama de McCabe-Thiele son líneas rectas.
Sin embargo, nuestro interés está en las condiciones dinámicas. Las asunciones anteriores, incluyendo retención despreciable del vapor, permiten que la velocidad del vapor a través de todos los platos de la columna sea la misma, dinámicamente es una buena asunción.
V = V1 = V2 = V3 = . . . = VNT
Recordar que los V’s no son necesariamente constantes con el tiempo. El vapor producto de la ebullición se puede manipular dinámicamente. El efecto matemático de asumir flujos equimolares es que no se necesita una ecuación de energía para cada plato. Esta es ciertamente una significativa simplificación.
Las velocidades de liquido a través de la columna no serán iguales dinámicamente. Ellas dependerán de la mecánica de fluidos de cada plato. A menudo la fórmula simple para vertederos dada por Francis se usa para relacionar la retención de liquido en el plato (Mn) a la velocidad de flujo del liquido saliendo del plato (Ln).
FL = 3,33 Lw (how)1,5 (3.78)
donde FL = Velocidad de flujo de liquido por encima del vertedero (pies3/s)
Lw = altura del vertedero (pies)
how = altura de liquido sobre el vertedero (pies)
Relaciones más rigurosas se pueden obtener a partir de ecuaciones detalladas para la hidráulica del plato para incluir los efectos de la velocidad del vapor, densidades, composiciones, etc. Asumiremos una relación funcional simple entre la retención de liquido y la velocidad de liquido.
Mn = f (Ln) (3.79)
Finalmente, despreciaremos la dinámica del condensador y el rehervidor. En columnas a escala comercial, la respuesta dinámica de este intercambiador de calor es usualmente mucho más rápida que la respuesta de la columna. En algunos sistemas, sin embargo, de este equipo periférico es importante y debe ser incluido en el modelo.
Con todas estas asunciones en mente, podemos escribir las ecuaciones que describan al sistema. Adoptando la convención usual, las ecuaciones de continuidad total son escritas en términos de moles por unidad de tiempo. Esto es consistente debido a se asume que no ocurre ninguna reacción química.
Tanque condensador y de reflujo
De continuidad total:
![]()
De continuidad por componente (componente más volátil):
![]()
Plato del tope (n = NT)
De continuidad total:
![]()
De continuidad por componente:
![]()
Plato siguiente al tope (n = NT – 1)
De continuidad total:
![]()
De continuidad por componente:
![]()
Plato n
De continuidad total:
![]()
De continuidad por componente:
![]()
Plato de alimentación (n = NF)
De continuidad total:
![]()
De continuidad por componente:
![]()
Primer Plato (n = 1)
De continuidad total:
![]()
De continuidad por componente:
![]()
Rehervidor y base de la columna
De continuidad total:
![]()
De continuidad por componente:
![]()
Cada plato y la base de la columna tiene ecuaciones de equilibrio [Ec. (3.77)]. Cada plato también tiene una ecuación hidráulica [Ec. (3.79)]. También necesitamos dos ecuaciones representando los controladores de nivel en la base de la columna y el tanque de reflujo mostrados en la Fig. 3.12.
D = f1(MD) B = f2(MB) (3.94)
Ahora examinaremos los grados de libertad del sistema. La velocidad de alimentación F y la composición z son asumidas que se dan.
Número de variables:
| Composiciones de los platos (xn y yn ) | = 2 NT |
| Flujos de liquido en los platos (Ln) | = NT |
| Retenciones de liquido en los platos (Mn) | = NT |
| Composición del tanque de reflujo (xD) | = 1 |
| Flujos en el tanque de reflujo (R y D) | = 2 |
| Retención en el tanque de reflujo (MD) | = 1 |
| Composiciones en la base (xB y yB) | = 2 |
| Flujos en la base (V y B ) | = 2 |
| Retención en la base (MB) | = 1 |
| 4 NT + 9 |
Número de ecuaciones:
| Ecuación | ||
| De continuidad por componente en el plato | = NT | (3.87) |
| De continuidad total en el plato | = NT | (3.86) |
| Equilibrio (platos más la base) | = NT + 1 | (3.77) |
| Hidráulica | = NT | (3.79) |
| Controladores de nivel | = 2 | (3.94) |
| De continuidad por componente en el tanque de reflujo | = 1 | (3.81) |
| De continuidad total en el tanque de reflujo | = 1 | (3.80) |
| De continuidad por componente en la base | = 1 | (3.93) |
| De continuidad total en la base | = 1 | (3.92) |
| 4 NT + 7 |
Por lo tanto el sistema está inespecificado por dos ecuaciones. Desde un punto de vista de ingeniería de control, esto muestra que solamente existen dos variables que pueden ser controladas (se pueden fijar). Las dos variables que deben ahora especificarse son el reflujo R y la cantidad de vapor producida por ebullición V (o entrada de calor al rehervidor). Estas pueden mantenerse constantes (en un sistema de lazo abierto) o puede cambiarse por dos controladores para convertir algunas otras dos variables constantes. En una simulación digital de esta columna en la Parte II asumiremos dos controladores de retroalimentación ajustando R y V para controlar las composiciones del tope y el fondo xD y xB.
R = f1(xD) V = f2(xB) (3.95)
3.12 COLUMNA DE DESTILACIÓN DE MULTIPLECOMPONENTES NO IDEAL
Como un ejemplo más realista, desarrollaremos ahora un modelo matemático para una columna de múltiple componentes, no ideal, con NC componentes, con flujos no equimolares, y platos ineficientes. Las asunciones que haremos son:
1. El liquido sobre el plato es incompresible y está perfectamente mezclado.
2. Las retenciones de vapor son despreciables.
3. Las dinámicas del condensador y rehervidor son despreciables.
4. El vapor y el liquido están en equilibrio térmico (la misma temperatura) pero no en equilibrio de fases. Se usará una eficiencia de Murphree para describir la desviación del equilibrio.
Donde ![]() = composición del vapor en equilibrio de fases con el liquido con
= composición del vapor en equilibrio de fases con el liquido con
composición xnj sobre el plato n
ynj = composición actual del vapor saliendo del plato n
![]() = composición actual del vapor entrando al plato n
= composición actual del vapor entrando al plato n
Enj = eficiencia de vapor de Murphree para el componente j sobre el plato n
Se permiten múltiples alimentaciones, ya sea como liquido o vapor, y salidas laterales, como liquido o vapor. Un plato n generalizado, se muestra en la Fig. 3-13. La nomenclatura es resumida en la Tabla 3.1.
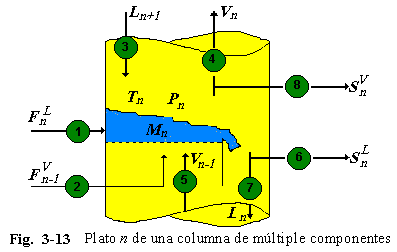
Las ecuaciones que describen a este plato son:
De continuidad total (una por plato):
![]()
De continuidad por componente (NC – 1 por plato):
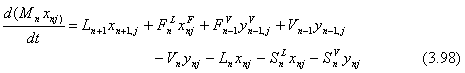
Ecuaciones de energía (una por plato):
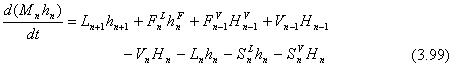
donde las entalpías tienen unidades de energía por mol.
Equilibrio de fases (NC por plato):
![]()
Se debe usar una apropiada relación de equilibrio liquido vapor, como la discutida en la Sec. 2.4.6, para encontrar ![]() . Luego la Ec. (3.96) se puede usar para calcular ynj para el plato ineficiente:
. Luego la Ec. (3.96) se puede usar para calcular ynj para el plato ineficiente: ![]() y Vn-1.
y Vn-1.
Ecuaciones adicionales incluyen relaciones de propiedades físicas para evaluar densidades y entalpías, una ecuación hidráulica del vapor para evaluar los flujos de vapor a partir de las caídas de presión conocidas en los platos, y una relación hidráulica para determinar el flujo de liquido sobre los vertederos a partir de las retenciones de liquido conocida en los platos. La discusión de la solución de este problema muy práctico y real se difiere para la parte II.
Si listamos todas las variables en este sistema y restamos todas las ecuaciones que lo describen y todos los parámetros que pueden fijarse (todas las alimentaciones), podríamos encontrar que los grados de libertad sean iguales al número de corrientes laterales más dos. Por lo tanto si no hay corrientes laterales, solamente hay dos grados de libertad en este sistema de múltiple componentes. Este es el número que encontramos en la columna binaria simple. Típicamente desearíamos controlar la cantidad de clave pesado impurificando el destilado xD.HK y la cantidad de clave ligero impurificando el producto del fondo xB,LK.
3.13 DESTILACIÓN “BATCH” CON RETENCIÓN
La destilación “batch” es frecuentemente usada para pequeños volúmenes e producto. Una columna se puede usar para separar una mezcla de múltiple componentes en lugar de usar NC – 1 columnas continuas. El consumo de energía en destilación “batch” es usualmente más alta que en continuas, pero raramente los costos de energía dominan la economía cuando se opera con volúmenes pequeños , y alto valor de los productos.
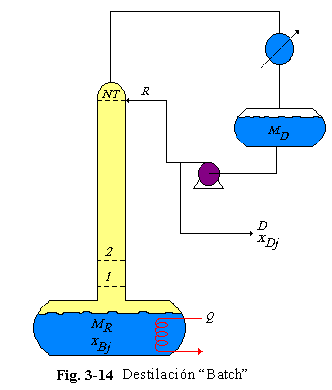
La Fig. 3-14 muestra una típica columna de destilación “batch”. Alimentación fresca es cargada dentro del recipiente en la base de la columna y calentada hasta comenzar la ebullición. El vapor asciende y sale por el tope de la columna, y es condensado en el condensador. El condensado liquido se envía al tanque de reflujo. Cuando se ha establecido el nivel de liquido en el tanque de reflujo, se bombea reflujo hacia el plato del tope de la columna.
La columna es operada a reflujo total hasta que la composición del destilado del tope con respecto al componente más ligero (componente 1) xD1, alcance la pureza especificada. Luego un producto destilado, el cual es el componente más ligero, es sacado a la misma velocidad. Eventualmente la cantidad de componente 1 en el tanque de ebullición ira bajando y la pureza del destilado xD1 disminuye. Hay un periodo de tiempo cuando el destilado contiene muy poco de componente 1 para ser tomado como producto y también muy poco de componente 2 para ser tomado como el siguiente producto mas pesado. Entonces se debe sacar un lote impuro (corte) hasta que xD2 alcance las especificaciones. Luego es obtenido un segundo producto. Con esto se pueden obtener múltiples productos en una columna simple.
El diseño óptimo y operación de columnas de destilación “batch” son problemas muy interesantes. El proceso se puede llevar a cabo variando la presión y a diferentes relaciones de reflujo durante la obtención de cada uno de los productos y los lotes impuros. El diseño óptimo de las columnas (diámetro y número de platos) y operación óptima pueden ser importantes en la reducción de tiempos de “batch”, con resultados en alta capacidad y/o mejorar la calidad de los productos (menores tiempos expuestos a altas temperaturas disminuye la degradación térmica).
Se asumen platos teóricos, flujos equimolares, y volatilidades relativas constantes. La cantidad total de material cargado a la columna es MB0 (moles). Este material puede ser alimentación fresca con composición z1 o una mezcla de alimentación fresca y cortes intermedios. La composición en el tanque de ebullición al inicio del “batch” es xB0j. La composición en el tanque en cualquier tiempo durante la operación es xBj. La retención instantánea en el tanque es MB. Se asume que la retención en los platos y la retención en el tanque de reflujo son constantes. La velocidad de retención de vapor es constante e igual a V (moles/h). El tanque de reflujo, los platos de la columna, y el tanque de ebullición son inicialmente llenados con material de composición xB0j.
Las ecuaciones que describen la destilación “batch” de una mezcla de múltiple componentes son dadas a continuación.
Tanque de ebullición:
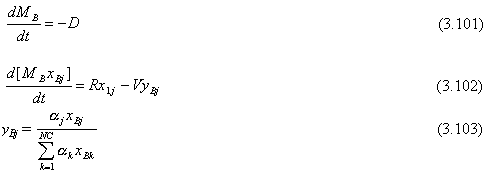
Plato n:
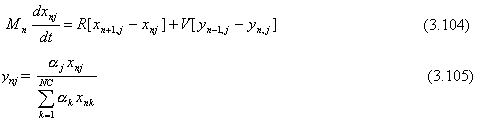
Plato NT (plato del tope):
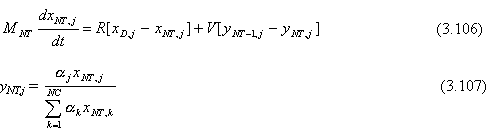
Tanque de reflujo
![]()
R = V – D (3.109)
3.14 SISTEMAS DE pH
El control de pH es un problema muy importante en muchos procesos, particularmente en tratamiento de aguas residuales. El desarrollo y solución de modelos matemáticos de estos sistemas son, por lo tanto, una parte vital del modelamiento dinámico de ingeniería química.
3.14.1 Modelos de Constante de Equilibrio
La aproximación tradicional es para mantener el curso de las cantidades de las diferentes especies químicas en el sistema. A cada punto en el tiempo, la concentración del ion hidrógeno es calculada mediante la solución de un conjunto de ecuaciones algebraicas simultáneas no lineales que resultan de las relaciones de equilibrio químico de cada reacción de disociación.
Por ejemplo, supongamos que se tiene un sistema típico de control de pH de aguas residuales. Varias corrientes de alimentación con diferentes especies químicas, curvas de titración, y niveles de pH son alimentados a un tanque perfectamente mezclado. Si las corrientes de alimentación son ácidas, alguna fuente de iones OH– es usada para mantener el pH sobre el valor especificado de siete. Un lodo de CaCO3 y/o soda cáustica (NaOH) es usualmente usada.
El método de la constante de equilibrio usa un modelo dinámico para mantener el curso de las especies químicas. Suponer, por ejemplo, que tenemos tres ácidos de disociación en el sistema. Manteniendo la concentración del ácido HA en un valor constante en el tiempo igual a CA. Esta concentración incluye la parte que es disociada, además de la parte que no es disociada. La misma cantidad para el ácido HB es CB y para el ácido HC es CC. Estos tres ácidos van al sistema en las corrientes de alimentación
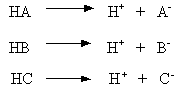
Las reacciones de disociación son reversibles y tienen diferentes constantes de velocidad directa y velocidad inversa. Las relaciones de equilibrio para estas tres reacciones son expresadas en términos de las constantes de equilibrio KA, KB y KC.

Para evaluar la concentración de ion hidrógeno [H+] en cualquier punto en el tiempo, estas tres ecuaciones algebraicas no lineales deben resolverse simultáneamente. Haciendo
x = fracción disociada de HA
y = fracción disociada de HB
z = fracción disociada de HC
Luego
Concentración de A– = x
Concentración de B– = y
Concentración de C– = z (3.113)
Concentración de HA no disociado = CA – x
Concentración de HB no disociado = CB – y
Concentración de HC no disociado = CC – z
Estas concentraciones son sustituidas en las Ecs. (3.110) a (3.112), dando tres ecuaciones algebraicas altamente no lineales con tres incógnitas: x , y, y z.
Estas ecuaciones no lineales deben ser resueltas simultáneamente a cada punto en el tiempo/ usualmente se usa un método iterativo y ocurren algunos problemas de convergencia. La complejidad aumenta cuando se incrementa el número de especies químicas.
Este modelo aproximado requiere que las especies químicas y sus constantes de equilibrio deben ser conocidas. En muchas situaciones de plantas actuales, estos datos no están disponibles.
3.14.2 Método de la Curva de titración
La información con que se dispone en muchas plantas químicas es una curva de titración para cada corriente a ser neutralizada, el método descrito a continuación se puede usar en esta situación. Esto involucra solamente un simple cálculo iterativo para una incógnita a cada punto en el tiempo.
Asumiendo que se conocen las curvas de titración para las corrientes de alimentación. Estas pueden ser típicamente curvas bien definidas para ácidos fuertes o curvas graduales para ácidos débiles, con o sin amortiguamiento. Estos modelos dinámicos siguen el rumbo de la cantidad de cada corriente que está en el tanque a cualquier punto en el tiempo. Haciendo Cn la concentración de la corriente n entrando al tanque, Fn el flujo de corriente entrando al tanque, y Fout el flujo total de material saliendo del tanque.
Si el volumen de liquido en el tanque es constante, el flujo de salida es la suma de todos los flujos de entrada. Las velocidades de flujo de soda cáustica y cal son usualmente despreciables.
Para tres corrientes de alimentación
Fout = F1 + F2 + F3 (3.114)
El balance dinámico por componente para la corriente n es
![]()
donde V = volumen del tranque
El balance dinámico para el ion OH– en el sistema es
![]()
donde FOH = velocidad total de flujo del ion OH– entrando al sistema en las corrientes de soda cáustica y el lodo de cal
Rdis = velocidad de generación de ion OH– debido a la disociación de partículas sólidas de CaCO3
COH = concentraciones de iones OH– en el sistema
La velocidad de disolución se puede relacionar al tamaño de la partícula y a la concentración de OH –.
![]()
donde k1, k2 y t son constantes determinadas a partir de datos de velocidades de disolución para CaCO3 sólido y XS es la concentración de CaCO3 sólido en cualquier instante.
Los pasos en el método de la curva de titración son:
- A cada punto en el tiempo, todos los Cn’s y COH son conocidos.
- Suponer un valor de pH en el tanque.
- Usar la curva de titración para cada corriente para determinar la cantidad de iones OH– requeridos para que la corriente alcance el valor deseado de pH.
- Verificar si la cantidad total de OH– actualmente presente (a partir de COH) es igual a la cantidad total requerida para todas las corrientes.
- Suponer otro valor de pH si en el paso 4 no se cumple la igualdad.
El método involucra solamente una iteración simple de una variable, pH. Para solucionar este modelo se puede usar muy efectivamente el método de la bisectriz (ver Cáp. 4). Las curvas de titración se pueden fácilmente convertir en funciones simples para incluirlas en el programa de computadora. Por ejemplo la sección de línea recta se puede usar para interpolar entre dos puntos.